Det finns en väldigt spridd missuppfattning/myt om att man kokar bort alkoholen ur glögg blixtsnabbt. Gubbarna står och vakar över kastrullen och skriker att ”nu är det dags annars kokar alkoholen bort”. Är det verkligen sant? Går det blixtsnabbt?
Det korta svaret är nej, det går inte alls blixtsnabbt. Häng med nu så ska en kemist förklara.
Vi börjar med en sammanfattning för er som inte orkar läsa
- Det tar längre tid än vad folk normalt tror att ”koka bort” alkoholen ur glögg.
- Tiden det tar beror på flera saker, framförallt kärlets vidd. Det går betydligt fortare att koka bort alkoholen om du kokar i en stor stekpanna än i en smal kastrull. Det kan även påverka om man har fläkten på eller inte.
- Det är omöjligt att koka bort alkoholen helt utan att koka bort exakt all vätska.
Vill ni förstå vad jag baserar ovanstående på så måste ni fortsätta läsa.
Några inledande kommentarer
En sån här text kan provocera för den vänder upp och ner på folks världar. Jag har skrivit om det förr på min första blogg Bara Riktig Mat (ska sägas att den bloggen är ful nu och sköts inte, den är kvar av nostalgiska skäl) och på Taffel men jag tänkte väcka liv i frågan igen. Den här gången med utgångspunkt i glöggen för det passar så bra i juletider.
Det finns två kategorier som kommer kunna ha åsikter om texten:
- Folk som minsann vet att jag har fel av erfarenhet. Till er säger jag att ni verkligen måste bevisa att jag har fel. Ni kan göra det empiriskt med goda metoder eller teoretiskt med smart resonemang.
- Kemister som tycker att jag inte berättar allt. Jag vet att jag inte gör det. Hela systemet är komplicerat och det här är en folkbildande text. Jag har approximerat och jag har förenklat, men bara i syfte att få alla att förstå. Jag kommer dessutom blanda begreppen etanol och alkohol och jag behandlar dem ekvivalent. Jag är väl medveten om att det finns en massa andra alkoholer än etanol. Deal with it.
Vad är det för myt vi pratar om?
Myten handlar om att ”alkoholen kokar bort först” och den är riktigt seglivad. Det handlar förmodligen om att folk har lärt sig att alkohol kokar vid 78,34°C (japp, folk kan decimalerna också). Alla vet dessutom att vatten kokar vid 100°C. Av det drar man slutsatsen att ”alkoholen kokar bort först”. Hettar man upp vätskan till 78,34°C så sticker alkoholen som en avlöning och därför är det viktigt att hålla sig under det. Det är fel, och jag ska förklara varför.
Fysikaliska egenskaper hos materia
Fysikaliska egenskaper som kokpunkt, densitet, fryspunkt/smältpunkt, viskositet etc, hos en blandning påverkas av dess sammansättning och det påverkar massor av saker i vår omgivning. Vi använder t ex vägsalt (kalciumklorid) för att sänka fryspunkten på vatten så vi inte får isiga vägar. Man kan få ner fryspunkten till runt -20°C genom att lösa saltet i vatten vilket gör att vi slipper en isbeläggning på vägbanan. Vatten med vägsaltsalt i har alltså en annan fryspunkt än rent vatten.
Vi blandar isopropanol, etanol och vatten för att få ner fryspunkten på spolarvätskan och där har vi faktiskt ett minimum när vi har en blandning på ungefär 50:50.
Kokpunkt
Det fungerar på samma sätt med kokpunkter. Kokpunkten är den temperatur vid vilken molekylerna i en vätska har tillräckligt med värmeenergi för att övervinna bindningarna mellan molekylerna (de så kallade vätebindningarna) och trycket med vilket molekylerna verkar mot ytan är högre än lufttrycket.
Rent vattens kokpunkt (vid normaltryck) är 100°C. Bindningarna mellan etanolmolekyler är svagare än de mellan vattenmolekyler och ren etanol har en kokpunkt på 78,34°C. Bindningsstyrkan mellan etanolmolekyler och vattenmolekyler ligger någonstans mittemellan och kokpunkten hos en blandning/lösning mellan etanol och vatten beror på dess sammansättning.
Det innebär också att du aldrig kan få någon högre temperatur på rent vatten än 100°C hur mycket du än värmer under normaltryck. En parentes här är att det är ett utmärkt sätt att kalibrera en termometer. Köper jag en sticktermometer så är det första jag gör att kolla den mot kokande vatten och ett isbad, då ska tempen visa 100 resp 0°C. Gör den inte det så har jag en kass termometer i handen.
Ytterligare en liten parentes kring ”normaltryck”, som jag nyss nämnde, är att man kan påverka kokpunkten med omgivande tryck också. Vid lågt tryck sjunker kokpunkten. På t ex toppen av Mount Everest topp kokar vatten vid 69°C. Vi har tryckkokare också och i en fungerande sådan så är trycket ungefär det dubbla mot normaltrycket och där ligger kokpunkten hos vatten kring 120C. En bra tumregel för kemiska reaktioner är att deras hastighet fördubblas var tionde grad. Att koka t ex kött mört är rakt av en fråga om kemiska reaktioner, man vill bryta ner kollagenet i köttet och därigenom bilda mindre proteiner som t ex gelatin. En ökning av kokpunkten från 100°C till 120°C ger fyra gånger snabbare kemiska reaktioner, alltså kan man dra ner koktiden på kalops till en fjärdedel av tiden.
Alkoholen kokar inte bort först
Vi har talat om vad kokpunkten är så nu kan vi bli mer specifika och i samband med det går jag också över till att prata om etanol som är alkoholen vi är intresserade av just nu. Vatten och etanol är fullständigt lösliga i varandra, vilket innebär att de blandas fullständigt och blandningens fysikaliska egenskaper blir gemensamma egenskaper, d v s blandningen får en gemensam fryspunkt, en gemensam kokpunkt, ett gemensamt ångtryck och en gemensam densitet med mera.
En gemensam kokpunkt alltså… Det är inte så att om du kokar finkonjaken så kommer vätskan först börja koka vid 78°C och där koka bort etanolen och sedan kommer vätskans temperatur sticka iväg till 100°C och där koka bort vattnet. Nej, kokpunkten är gemensam och beror av blandningens sammansättning. I bilden nedan visas ett så kallad fasdiagram över systemet etanol/vatten och ur det kan man utläsa hur kokpunkten varierar med etanolinnehållet i en etanol/vatten-blandning.
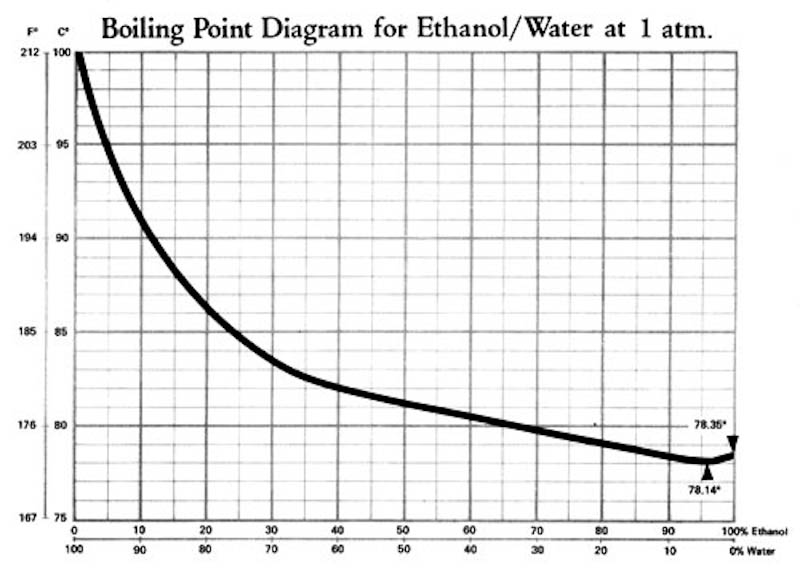
Där ser vi t ex att finkonjaken (40%) kokar vid drygt 80°C, glöggen (15%) kokar vid 90°C och Strohromen (80%) som Freddie snodde av sin morsa i åttan kokar vid 75-80°C. Det här kan du testa om du inte litar på mig. Vanliga hushållstermometrar är ofta väldigt pålitliga i intervallet 0-100 °C och det är bara att du kokar upp skitvinet, stoppar ner en termometer och läser av. OBS. Det är viktprocent som visas i diagrammet och alkoholhalt i drycker anges i volymprocent (vilket man som kemist hatar).
Det man måste fråga sig är vad det är som övergår från vätskefas till gasfas när din etanol/vatten-blanding kokar. Om du kokar konjaken, har då också gasen ett etanolinnehåll på 40%? Nej, det har den inte. Gasen innehåller proportionellt mer etanol än vätskan vid en viss temperatur. Detta går att läsa ut ur nedanstående diagram, där gasens sammansättning vid olika temperaturer representeras av den röda kurvan. Den blå kurvan är samma som är utritad i (men nu i volymprocent). Nu inser jag att det kan bli lite svårt och jag tänker inte förklara varför den röda kurvan ser ut som den gör, vill ni förstå den så läs kemi på universitetet.
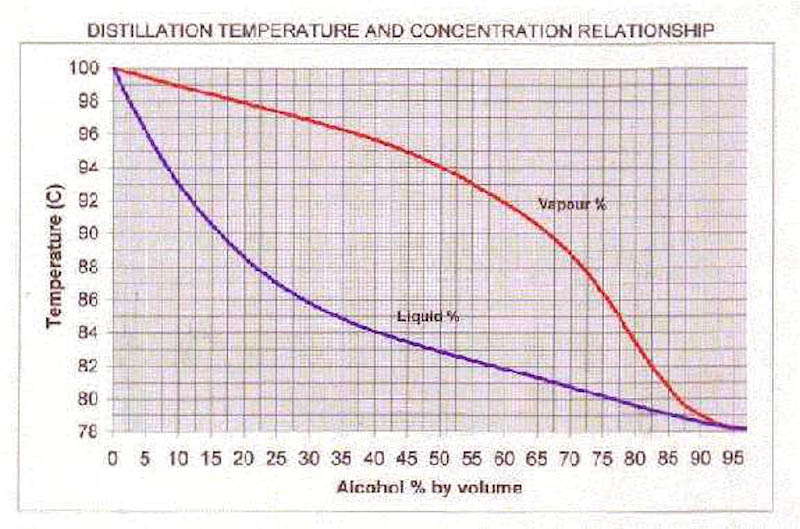
Låt oss använda diagrammet ovan och ta reda på vad den bildade gasen har för alkoholhalt när vi kokar finkonjaken. Dra en linje upp till den blå kurvan från x-axeln (horisontella axeln i grafen). Där kan vi läsa av kokpunkten som 84 °C.
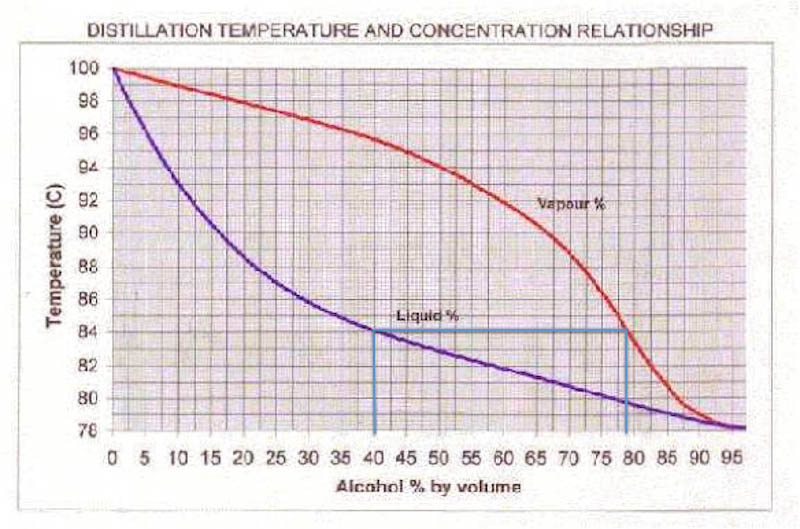
Dra sedan en horisontell linje åt höger tills du stöter på den röda kurvan. Dra sedan ner och läs av sammansättningen. Det är sammansättningen på den bildade gasen. Kokar du konjaken så har den bildade gasen en alkoholhalt på ungefär 77%. Det är så klart bara när den precis börjar koka. Under tiden som mer gas sticker iväg så sjunker ju givetvis alkoholhalten i vätskan. Ha! Precis vad vi är ute efter när det kommer till glöggen. Då kommer också alkoholhalten hos den bildade gasen minska. När din dryck gått ner till ungefär 8% alkohol så kommer gasen som bildas ha lägre halt etanol än vatten, d v s mer vatten än alkohol kokar bort.
Det här med att gasen innehåller procentuellt mer etanol än vad vätskan gör vid kokpunkten är nyckeln till destillering. Vid destillering kyls gasen så den kondenserar (övergår från gas till flytande) och får rinna ner i ett annat kärl. Man kan ta reda på vad sammansättningen är på gasen genom att dra några linjer i bilden (se nedan).
Hur sjunker alkoholhalten under kokning?
Här börjar det bli riktigt knepigt. När jag tänkte på det här första gången, sex år sedan, så insåg jag att man borde kunna räkna på det som sker. Man borde kunna korrelera volymsminskningen på vätskan mot alkoholhalten i den. Dessvärre är jag ingen vidare fena på avancerad matte så jag efterlyste hjälp här på bloggen. Alltså jag är skaplig på matte efter totalt ett år ren matte på universitetet men det är många år sedan. Hjälp fick jag av en civilingenjör vid namn Henrik Gustavsson. Han gjorde ett simuleringsprogram i Excel som kan användas för att simulera hur alkoholhalten sjunker med volymreduktion med hjälp av differentialkalkyl. I excelarket kunde jag mata in ursprungskoncentrationer och få ut hur mycket jag ska reducera den för att erhålla en alkoholhalt som är 0,5% (vilket är definitionen av alkoholfritt). Vin som i regel innehåller runt 15% alkohol kommer vara alkoholfritt när du har 1/3 av volymen kvar. Nu är det så pass illa så jag tappat bort excelarket så om Henrik läser det här så tar jag tacksamt emot det igen.
Man ska komma ihåg att det har gjorts en del approximationer här. Salter och sockerarter, som så klart finns i mat, ändrar kokpunkten hos en vätska. Dock har jag antagit att de förekommer i så små mängder så det inte påverkar kokpunkterna nämnvärt. Ska ni koka likör med massor av socker så kommer det bli betydligt mycket trassligare att beräkna. Å andra sidan, vilken idiot kokar likör egentligen?
En annan sak som påverkar hur mycket vätska som övergår till gasform är borttransporten av gas från ytan. Det där är klassisk jämviktslära (läs universitetskemi du också!). Kan du transportera bort gasen så går det fortare att fylla på med mer. Du kan ställa upp fläkten ordentligt eller stå utomhus en blåsig dag så går det fortare.
Glögg
Så vad betyder då det här för patriarken som står vid spisen och vaktar glöggen? Jo reducerar du knappt ner volymen så har du inte påverkat alkoholhalten så mycket.
Nu vet ju den uppmärksamma hemmakemisten att det ångar av vätskan även innan den kokar. Innan kokpunkten så är det rätt så liten volymsreduktion. Kolla själv! Har inte volymen sjunkit signifikant så kan du räkna med att din glögg fortfarande ger dig det eftertraktade ruset.
Att prata om tid här, vilket typ alla källor gör, är egentligen irrelevant. Hur mycket vätska som övergår till gasform påverkas av vätskeytans storlek. En liter vätska i en stor stekpanna reduceras fortare än samma volym i en kastrull där ytan blir mycket mindre. Det där vet ni nog redan och det gäller för glöggen också. Kasta ner en liter glögg i en glödhet muurikka så ska du se att det går undan för exakt allt att koka bort. Därmed inte sagt att tiden är irrelevant att prata om. Jag tror inte så många värmer sin glögg i muurikka utan alla använder en standardkastrull.
Det är också skillnad på stormkokning och försiktig kokning. Det beror på att det kokar så mycket så att ytan blir väldigt ojämn och den totala ytan hos vätskan som exponeras mot luften blir då betydligt större. Kokar du glöggen försiktigt så tar det en viss tid att koka bort alkohol och stormkokar du så går det fortare. Undvik att stormkoka så är det ingen fara.
Mer glögg på Feeders
Vi har en del roliga glöggrelaterade grejer på bloggen och alla hittar du här.
Mer matrelaterad kemi på Feeders
Det här med kemi och mat intresserar mig och jag vill hemskt gärna förstå saker på riktigt. Jag har gått igenom diverse aspekter genom åren och vi har även en del på Feeders.
Här diskuterar jag bl a vetenskapen hos matlagning med sous vide.
Folk har missuppfattat det där med saltkoncentrationer när de rimmar kött. Enkel kemi, men folk tänker inte på det. Läs mer här.

